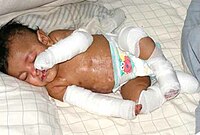
Una pareja de Wrexham (Reino Unido) vive aterrorizada por la posibilidad de que su pequeña Tianne llore. La razón: puede provocarle la muerte.
Tianne Lewis, de sólo dos años de edad, sufre RAS (Reflex Anoxic Seizure), un extraño mal que no permite la circulación de la sangre al cerebro cuando algo le sorprende o le hace llorar.
Andy McHugh y su prometida Ceri Lewis explican a la BBC que cualquier cosa que haga llorar a su pequeña puede parar su corazón: “Su corazón puede detenerse cuando llora y tenemos que darle golpes, por muy duro que suene, para no perderla”, explican.
Los médicos descubrieron el mal en la niña cuando tenía 18 meses y le dieron pocas esperanzas de vivir. “Nos dicen que si tardamos en hacerla reaccionar (cuando sufre los primeros espasmos que pueden llevarla a que su corazón se pare) más de 10 o 15 minutos, podríamos perderla”.
No hay una solución 100% eficaz para este extraño síndrome y los padres de Tianne piden, mientras confían en que su hija supere esta dolencia, que las autoridades sanitarias muestren más interés por una dolencia que, según afirman, padecen el 39% de los pequeños diagnosticados con epilepsia.
Qué es este síndrome
Este síndrome provoca que no llegue sangre al cerebro cuando un niño llora o se sorprende por algo. Se estima que ocho de cada mil niños con problemas diagnosticados como epilepsia lo padecen en el mundo. Suele tratarse con medicamentos específicos como la atropina, algo que hasta la fecha parece detener algunos de los ataques. La mayoría de casos se dan entre los seis meses y los dos años.
FUENTE: 20 Minutos
ahora e encontrado esta informacion mal traducida en una web dedicada a este tipo de enfermedades
Los Ataques de Reflejo Anoxico ocurren principalmente en ninos pequenos, pero pueden ocurrir a
cualquier edad. Un estimulo inesperado como el dolor, el shock o un susto causa una parada cardiorespiratoria,
que los ojos se queden en blanco, que la piel parezca muerta con un color grisaceo, a
menudo azulado bajo los ojos y alrededor de la boca, que la mandibula se apriete y que el cuerpo
que ponga rigido, a veces con convulsions en brazos y piernas. Despues de unos 30 minutos el cuerpo
se relaja, el corazon y la respiracion se reestablecen y la persona permanece inconsciente. Uno
o dos minutes despues la persona puede recobrar la consciencia, en cambio puede permaner inconscienta
a lo largo de una hora aproximadamente. Durante la recuperacion, la persona, quizas devil
emocionalmente, podria caer en intervalos de sueno que durarian unas 2 o 3 horas con apariencia
extremadamente palida.
Los ataques del RAS pueden ocurrir varias veces al dia, a la semana o al mes. Estos ataques aparecen
en periodos.
Desafortunadamente, devido a sus sintomas, el RAS es diagnosticado erroneamente como una fuerte
rabieta, una parada respiratoria o como epilepsia.
1 Que son los ataques de refl ejo anoxic?
Los ataques de refl ejo Anixic ocurren principalmente en ninos pequenos pero pueden ocurrir en adolescents
o adultos. El golpe repentino de dolor( apenas aprciado), o verdaderamente algun estimulo
inesperado causan una parada cardiaca, que los ojos se queden en blanco, que la tez tenga un
color grisaceo, la mandibula se aprieta y el cuerpo se pone rigido com convulsions de brazos y piernas.
Despues de unos 30 minutos el cuerpo se relaja, el corazon y la respiracion se reestablecen y la
persona permanece inconsciente. Uno o dos minutes despues la persona puede recobrar la consciencia,
en cambio puede permaner inconscienta a lo largo de una hora aproximadamente. La victima
duerme durante 3 o 4 horas despues de un ataque.
El RAS es a menudo diagnosticado erroneamente como simple parada respiratoria o mas gravemente
como epilepsia.
2 Cual es la edad de la victima mas joven y mas vieja conocida des RAS?
La victima mas joven conocida tuvo si primer ataque el primer dia de vida. Hay victimas del RAS con
50 o 60 anos.
3 Que cusa el RAS en ninos?
Los ataques del RAS son davidos a que el nervio vago esta sobreestimulado devido a un estimulo inesperado
causado por el dolor, un golpe o el temor. No se sabe por que esto solo acontece en algunos
ninos.
4 Para el corazon durante el fallo? (halamos de fallo refi riendonos a un incidente donde
la persona deja de respirar despues de un susto u otros estimulos, pero que recupera la
el ritmo normal antes de perder el sentido)
El corazon no para, simplemente va mas lento durante este periodo.
5 Con el tiempo hara que se devilite el corazon?1)
No, un ataque del RAS no supone ningun esfuerzo para el corazon
6 Colocar al nino en posicion de recuperacion inmediatamente despues de que se
produzca el susto o cualquier otro esrimulo y antes de que se produzca la perdida de
consciencia, puede disminuir la severidad del ataque o o tener como resultado un fallo
cercano. Hay alguna base medica para esto?
Este parece ser el caso aunque los doctores no tengan seguro un porque. Se debe saber que la persona
no tiene que ser colocada siempre en posicion de recuperacion
7 el ataque del RAScausa danos cerebrales a corto o largo plazo?
No hay ninguna evidencia de que el RAS cause dano al cerebro. Cuando se produce el fallo, el cerebro
vuelve a encender el latido del corazon y la respiracion antes de que la falta de oxigeno cause
dano
8 si la parada cardiorespiratoria continua mas alla del tiempo de reaccion normal del
nino se debe administrar la RCP (reanimacion cardio pulmonar)?
Es extremadamente improbable que la RCP sea necesaria cuando ay un fallo de este tipo. Sin embargo
si el corazon y la respiracion no han vuelto a sus funciones en un periodo de un par de minutos
entonces la RCP procurada no aria dano.
9 Cuando crecen los ninos sin ataques y que porcentaje de ninos continua con ataques
despues de la edad de escolarizacion?
Los ataques en los ninos suelen disminuir a medida que se van haciendo mayores, pero nunca
pueden librarse de ellos completamente. Las estadisticas no publicadas dicen que el 75% de los ninos
superasn el RAS en edad de escolarizacion; sin embargo uno de cada cuatro continua teniendo los
ataques aunque menos frecuentes.
10 Conoce usted a algun adulto con RAS?
Si
11 Hay algun grupo de apoyo para ellos?
Si. La informacion de RAS & el grupo de apoyo ata abierta a todo el mundo
12 cuando un nino es demasiado mayor para asistir a un hospital de ninos, a que hospital
deben asistir y alli conoceran el RAS?
El paciente sera enviado al hospital de adultos mas cercano. Es necesario que tengan toda la informacion
de antemano. Un particular entrega el plan que necesitan seguir, aveces un cardiologo, a veces
al GP, depende del caso individual.
13 Porque unos ninos recobran el conocimiento mas rapido que otros?
Los ninos son muy diferentes en cuanto a la recuperacion de ataques, en parte es devido a la severidad
del ataque y parcialmente devido a la propia reaccion del cuerpo frente a dicho ataque
14 El nino puede padecer RAS mientras duerme?
Probablemente no, sin embargo ay otras condiciones que causan paradas cardiacas, sindrome notablemente
prolongado de QT, que ocurre durante el sueno, y mientras se despierta especialmente
con ejercicio. El sindrome prolongado de QT se puede diagnosticar mediante un electrocardiograma
(ECG), y los padres son alentados a someter al nino a esta prueba para excluir este diagnostico.
15 Por que un nino sufre mas ataques de RAS cuando esta con sus padres?
Hay dos teorias, ona es que el nino tuvo la mayoria de los ataques cuando era pequenin, cuando
pasaba la mayor parte del dia con sus padres. Otra teoria es que el nino se siente mas relajado en su
ambiente, el no anticipa un susto, por lo tanto es mas probable que tenga ataques de RAS por el susto
o shock inesprado.
16 Cuales son los preoblemas de un nino que padace RAS frente a la anestesia?
Apretando los globos oculares se puede estimular el nervio vago xa que produzca un ataque de RAS
( la preueva de compresion ocular) y cuando se esta anestesiado se produce cuando el tubo presiona
hacia abajo la garganta. Sin que el paciente se de cuenta se debe administrar una dosis de antropina
en el preoperatorio y no habram complicaciones adicionales.
Las complicaciones aparencen cuando, sobre todo en la anestesia bucal, las victimas del RAS se anestesian
incorporadas y la sangre baja mas facilmente a las piernas. Cuando el corazon recobra sus
funciones, la falta de sangre en este podria causar arresto cardiaco. Entonces se podrian llegar a dar
complicaciones incluso en el cerebro. Nuestro consejo es decir siempre a los anestesistas que el paciente
sufre ataques de RAS e insistir en que la anestesia se administre sin que lo sepa el paciente.
17 Que siente el nino durante las etapas de un atauqe de RAS?
Pocos ninos han sido capaces de describir lo que seinte durante los ataques y mencionan que escuchaba
sonidos muy lejanos y que se sentian bien. Dicen que no es agradable recobrar el conocimiento
18 Hay un factor genetico en los ataques del RAS?
Se necesita estudiar mucho mas para saber cual es el gen que nos hace susceptibles frente a los
ataques del RAS. Un esquipo dela Hospital Infaltil de Birmingham espere identifi car en gen responsable
mediante la investigacion.
19 Sufrira mi nino RAS durante su ninez?
Es bastante posible ya que ahora se sabe que los ataques del RAS y los desmayos frecuentes son eredados
de los amiliares.
20 Podria llevar la gente con RAS una tarjeta como la gente epilepsica o con diabetes,
con “RAS” en un lado e instrucciones para precticar primeros auxilios en el otro?
El medico etiqueta colgantes o munequeras de alerta apropiados para la persona que padece RAS.
Los folletos de aplicación, que deben ser contrafi rmados por su doctor, estan disponibles en el grupo
de apoyo de RAS.
21 Hay alguna coneccion entre el RAS y otrasa condiciones medicas como la enfermedad
temprana de ninez, los murmullos de corazon o demora de desarrollo?
Por lo que saben los p[eritos medicos la respuesta es no.
22 Que se le puede decir a un nino para aliviarlo durante un ataque?
Prece que hablarle suavemente y alentarle durante un ataque ayuda a su nino ya que perciben los
sinidos de las voces.
23 Que problema se asocia con las vacunas ( ya sean inyecciones verdaderas o mecanismos
de inmunizacion)?
Ninguno, aunque es posible que se causen por el miedo a la inlleccion. Se debe hablar con el nino y
alarmerlo para que se anticipen al dolor. En general esta el interes de los ninos en prebenir el riesgo
ante la enfermedad.
24 Algun nino ha tenido algun ataque de aRAS en el agua? Si es asi, que ocurrio?
Si- afortunadamente el padre lo advirtio inmediatamente y no se causo ningun dano. El estimulo producido
mediante la salpicacion de agua fria en la cara, es un estimulo totalmente aislado del nervio
vago, y puede tener como resulatado un ataque. El nino que sufre RAS debe aprender a nadar xo
siempre debe estar vajo la supervision paterna dentro del agus.
25 cuales son los problemas que se asocian con la cirujia dental?
Loas problemas de la cirujia dental es la administracion de la anestesia (16) hasy un folleto de informacion
disponible para dentistas en el centro de RAS.
26 Por que llora un nino despues de un ataque de RAS?
Losd doctores no estan seguros. Podria deberse al desequilibrio quimico en el cuerco despues de un
periodo de anoxia, o quizas estar devido a la experiencia del nino estando inconsciente. Quizas el
nino se enfrenta subconscientemente a la emocion y el golpe del ataque.
27 Son comunops los dolores en estremidades en gente que padece RAS?
Si, sin embarga hay muchos ninos que sufren dolores en las piernas sin padecer el RAS. Se espera que
se inbestigue si se puede saber si la gente con RAS es mas susceptible a los dolores de piernas.
28 Hay alguna conexión entre un nacimiento complicado y el desarrollo del RAS?
No
29 Que informacion debe suministrarse a playgroup y escuelas para asegurarse de que
el personal conozca los riesgos?
Hay una hoja de informacion para escuelas y playgroups disponible en los centros de informacion
sobre el RAS, asi como un video para mostrar a maestros como es en realidad un ataqueLOs folletos
de informacion estan disponibles tanto para maestros como para ninos con RAS que van a empezar
la secundaria en el instituto. Muy pocos ninos tiene ataques de RAS en la escuela.
30 cual a sido el tiempo mas largo entre ataque y ataque de una vicyima de RAS?
10 anos
31 Puede ser controlado el ataque de RAS una vez que el nino haya esperimentado el
susto a cualquier otro estimulo?
El nino no tiene control sobre el proceso. En las etapas tempranas algunos padres pueden impedir el
ataque con una combinacion de alentar al nino, habalarle y colocarle boca abajo en la posicion de
recuperacion o soplandole a la cara. Los ninos son diferentes asi que responderan diferentemente.
32 Algun consejo para afrontar la convivencia dia a dia de una familia con un nino de
ras?
Es importante que un nino que padezca RAS tenga una vida sana y normal, sin embargo los adultos
que conviven con el nino deben de saber cuales son las condiciones del nino. Contacte con un grupo
de apoyo de RAS para informacion y consejoa adicionales.
33 A un padre le han recomendado que no abrace a si hijo mientras padece un ataque
de RAS y que permita que sea el nino quien se acerque y lo rodee a el. Es un buen consejo?
El mejor consejo es que se debe tener al nino que lo padece en la posicion de recuperacion y yacer
a su lado, hablarles calmadamente y alentarles tocandoles apropiadamente (frotandoles la espalda,
tocandoles l brazo...)Su voz debe sonar calmada y alentadora.
34 Porque durante un ataque el nino se pone blanco y no azul?
Durante un ataque de ras se produce una parada cardiorespiratoria, lo que proboca que los vasos
se contraigas y la sangre no llegue al tegiso cutaneo. Esto tiene como respuesta la palidez blanca de
la piel. La sangre llegara sin oxigeno y sera notable el color azul solo en los labios y en etapas tempranas
del ataque. L a causa de este color azul; es devido a la falta d oxigeno en los pulmones. Sim
embargo, cuando el corazon todabia bombea el cuerpo se pone de color azul devido a la llegada de
sangre sin oxigeno a los tegidos cutaneos de la piel.
35 Porque duerme un nino tamto tiempo despues de un ataque de RAS?
No se sabe a ciencia cierta. Probablemente se debe a la recuperacion del cerebro despues de un
ataque. Durante un ataque el corazon para de bombear aproximadamente entre 5-30 seg. Posteriormente
ay unos 9 o 10 seg. En los que el cerebro no recibe riego sanguineo, por lo que la actividad de
la corteza cerebrel (parte pensadora) se para. Cuando el corazon camienza a bombear otra vez, la
corteza cerebral vuelve a sus funciones muentras el nino duerme un par de horas despues de la recuparacion.
Esto no dana el cerebreo.
36 Que esrtimulos se pueden dar en anos posteriores?
Los estimulos postriores difi eren completamente del Shock a de las caidas de un pequeño con ras.
Estos pueden incluir el engarrotamiento de dedos, dedos de stubbing, ver sangre, etc…se necesita
descubrir la que estos estimulos causan en los ataques con una investigacion a largo plazo.
37 Donde esta el nervio vago, cual es su funcion normal y que es lo que desarrolla durnte
el ataque de RAS?
Hay una hoja completa de esquemas e informacion en el centro de apoyo de ras.
38 Podria causar el nevio bago otros sintomas como los desmayos, enfermedades o
afectar a la tension arterial?
El nervio vago tiene muchas funciones. Hay hojas de informacion disponibles. (ver 35)
39 Que hace que el corazon vuvelva a sus funciones despues de un ataque?
Cuando diaminuye el niver de oxigeno en el cerebro hay una liberacion de productos quimicos que
hace que el corazon y los pulmones vuelvan a su actividad normal.
40 En que difi ere un ataque de Epilepsia de un ataque de RAS?
Un EEG (actividad del cerebro) de un ataque epileptico mostraria una optativa excesiva o descargas
epilepticas, que no estan presentes en un ataque de RAS. En el EEG de unataque de RAS se va afl ojando
durante unos pocos segundos, entonces la actividad del cerebro cesa, seguidamente sigue suabe
durante la fase de sueno hasta que vuelve a la normalidad. Un ataque de ras siempre viene dado por
un estimulo fuerte como un golpe, aunque a veces sea difi cil identifi carlo.
41Cuando y vcomo previene la Atropina los ataques, se debe preescribiry cuales son los
efectos secundarios?
Hay una hoja de informacion en los centros de apoyo de RAS
42 cules son las investigaciones que se llevan a cabo durante un ataque de RAS?
Uno de los componenetes del grupo debe promover la investigacion. Un proyesto reciente, un marcapasos
apropiado para los ninos con ataques de RAS, ha fi nalizado. Una copia del folleto publicado
esta disponible en los centros de apoyo de RAS. El grupo saco fondos para comprar los mejores monitores
de corazon. Estos monitores que llevara la persona, en un periodo de tiempo, proporcionaran
una informacion esencial de la actividad del corazon durante un ataque de RAS. Esperamos que la informacion
engendrada se utilice par ala investigacion. Comisionar tambien una investigacion medica
de todos nuestros mienbros, que proporcionara una valiosa investigacion auxiliar pro-datos. Es esencial
la informacion que puedan darnos las personas que yeven mucho tiempo padeciendo ataques de
RAS, si usted no lo ha hacho, hagalo ya.
43 Que se puede hacer para prevenirle a un nino los ataques?
Preescribirla Sulfato de Atropina, Metronitrato de Atropina o medicamentos semejantes ( la terapia del
Hierro quizas ayude a muchos ninos) Desgraciadamente estas medicinas no siempre dan resultado.
La frecuensia de ataques y la severidad de estos ha disminuido o se han eliminado en las gente que
ha tomado estos medicamentos.
44 Cuantos ninos yevan marcapasos?
Doce ninos llevaron marcapasos durante la investigacion del Hospital infantil de Yorkhill.
45 Si un nino asiste a una sesion de 6 mesen con marcapasos, y este no ha hecho su
funcion cuando es necesario, se quitaria?
No, no necesariamente
46 si se ha quitado el marcapasos y los ataques vuelven a aparecer, se pondria nuevamente?
No necesariamente, dependeria de la frecuencia y la severidad de los ataques, y como estos afectan
al individuo. El marcapasos se utiliza como un trtamiento, no como una curacion,
47 Ahora que la investigacion esta terminada, se publicaran los ayazgos y, podremos
obtenerlos?
Si, los resultados del proyecto se publicaran y el grupo de apoyo de RAS mandara una copia sobre el
pedido.
48 Porque afecta el ras solo a un porcentage de ninos pequenos?
No se sabe.
49 Hay otros paisses en los que los ninos sufren RAS?
Si8, y muchos estan en contacto con el grupo de RAS. La pagina web (www.stars.org,uk )ha aumentado
el conocimiento y la informacion proporcionada para la gente de todo el mundo.
50 A cuanta gente le afecta?
Desgraciadamente no tenemos ningun dato
51 Hay alguna conexión entre la falta de hierro en sangre y los ataques de RAS?
Posiblemente. No hay evidencias sufi cientes actualmente, según los doctores la terapia de conexión
con el hierro puede ayudar a algunos ninos.
52 Hay alguna conexión entre alergias dieteticas y RAS?
No
53 Hay alguna forma en la que se pueda presentar a su GP una demostracion de que al
nino le ha sido diagnosticado RAS?
El doctor escribe al GP despues de la consultay el diagnostico, pero el GP puede necesitar informacion
adicional. Hay un follerto de informacion para profesionales medicos en el grupo de apoyo de RAS.
54 Los ninos mas mayores estan avisados de alguna situacion que quizas tenga como
oconsecuencia un ataque?
Si, parece ser que ellos estan alertados de los peligros e intentan evitarlos.
55 Hau algun problema con el cubrimiento del seguro en ninos con RAS?
Las escuelas de playgroups deben de de saber las condiciones del nino y por consiguiente deven
avisar a su compania de seguros. Las companias de seguros de viajes se deben informar de la condicion
de la persona y deben adquirir una carta del doctor diciendo que la persona esta en condiciones
de viajar. Esto no debe aumentar su prima. Algunas companias de seguros privados de la salud
pueden rehusarse a cubrir alguna herida causada o relacionada con un ataque de RAS.
56 Hay alguna pauta de la frecuencia de los ataques?
Parece ser que los ataques aparecen por series, pero nosotros no sabemos por que.
57 Ras es mas comun en chicos o en chicas?
Levemente mas comun en chicas
58 Es posible que un nino tenga un ataque de RAS durante su nacimiento?
Si, es posible, pero nosotros no conocemos ningun incidente, el bebe debe venir sin noingun dano.
fuente: http://www.stars.org.uk/