Dudas y sugerencias sobre el blog escribir a israelortegapuente@gmail.com también si desean que publique algo que pueda ser de interés para los demás no olviden en contactarme.
viernes, 14 de mayo de 2021
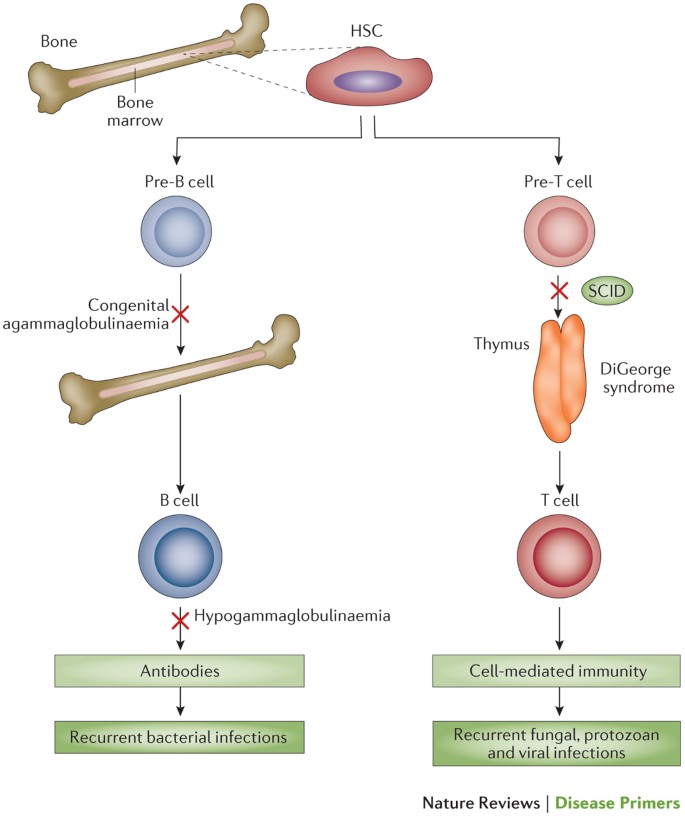
Sindrome de Omenn
miércoles, 12 de mayo de 2021
Sindrome de san filipo
- Retraso del habla y otros tipos de retrasos del desarrollo
- Sufrir muchas infecciones de oído y/o muchas infecciones de senos nasales
- Cabeza más grande de lo normal
- Infecciones respiratorias
- Problemas de comportamiento que se parecen a los que están causados por el autismo
- Comportamiento compulsivo e hiperactividad
viernes, 7 de mayo de 2021
Síndrome de Paget-Schroetter
El síndrome de Paget Schroetter (PSS) es una trombosis inducida por el esfuerzo de las venas axilar y subclavia asociada con la compresión de la vena subclavia en la salida torácica. Es la variante venosa del síndrome de salida torácica (SOT). La descripción de esta entidad se remonta a 1875 cuando Sir James Paget informó de un caso de trombosis espontánea de la vena subclavia en un paciente. En 1884, von Schroetter planteó la hipótesis de que la afección era consecuencia de una lesión en la vena por movimientos musculoesqueléticos repetitivos.
Incidencia
Su incidencia es de 2 por 100.000 habitantes y afecta a jóvenes (edad media 32 años) principalmente varones (2:1)3, en la extremidad superior dominante. Hasta el 80% de los pacientes refieren actividad física importante con movimientos de separación y rotación externa. La clínica clásica consiste en dolor, edema y sensación de pesadez en el miembro afectado. El inicio es brusco, en el 85%1 de los casos los síntomas comienzan antes de 24h desde la realización del ejercicio.
Fisiopatología
La tensión repetitiva de la actividad física vigorosa y la compresión de la vena subclavia de las estructuras anatómicas adyacentes conduce a la lesión venosa y la trombosis subsiguiente. Esto impide el retorno venoso de la extremidad afectada provocando edema. Con el tiempo, el cuerpo forma colaterales para evitar la obstrucción venosa. En la fase crónica, la vena se vuelve fibrótica. Los cambios inflamatorios circundantes de la trombosis conducen a la formación de tejido cicatricial.
Diagnóstico
El eco-doppler es la primera técnica diagnóstica a realizar. En manos expertas es muy sensible (78-100%) y específica (82-100%). El siguiente paso es la flebografía en la que se puede objetivar trombosis de la vena subclavio-axilar en la unión costoclavicular y presencia de abundantes colaterales. En caso de no observar dicha obstrucción, la presencia de colaterales siempre implica cierto grado de estenosis. Las maniobras de provocación, como la separación de la extremidad, pueden ayudar al diagnóstico.
Tratamiento
No hay un claro consenso respecto al tratamiento. Hoy en día, la mayor parte de los autores están de acuerdo en que la anticoagulación en monoterapia ofrece malos resultados, por lo que se recomienda asociarla a fibrinólisis y a tratamiento quirúrgico y/o endovascular.
La fibrinólisis con estreptoquinasa o urocinasa intratombo en fase aguda (antes de 10 días) es muy efectiva (hasta 100%) y segura, siendo el tratamiento de elección5. Dado que la desaparición del trombo no resuelve el cuadro ni elimina la compresión venosa, se recomienda realizar cirugía descompresiva. Previamente a dicha cirugía, la angioplastia o la colocación de stent no están indicadas, ya que pueden lesionar más el endotelio y la articulación puede llegar a obstruir e incluso romper el stent,
Bibliografía
Saleem T, Baril DT. Síndrome de Paget Schroetter. [Actualizado el 7 de junio de 2020]. En: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021 enero-. Disponible en: https://www.ncbi.nlm.nih.gov/books/NBK482416/
Lorence-Herte et al. 2011. Síndrome de Paget Schroetter. Cirugía Español editorial Elsevier.